Đề kiểm tra học kỳ I - Môn: Hoá lớp 10
I. Trắc nghiệm
Câu 1: Cho các nguyên tử có kí hiệu sau: . Nhận định nào sau đây đúng khi nói về 3 nguyên tử trên:
A. X, Y thuộc cùng một nguyên tố hoá học
B. X, T là 2 đồng vị của cùng một nguyên tố hoá học
C. X và T có cùng số khối
D. X và Y có cùng số nơtron
Câu 2: Cho các chất sau: NH3, HCl, SO3, N2. Chúng có kiểu liên kết hoá học nào sau đây:
A. Liên kết cộng hoá trị phân cực B. Liên kết cộng hoá trị không phân cực
C. Liên kết cộng hoá trị D. Liên kết ion
Câu 3: Cấu hình electron của X là: 1s22s22p63s23p1 thì X là nguyên tố:
A. Al B. Ca C. Ar D. Cl
Câu 4: Số oxi hoá của nguyên tố lưu huỳnh trong các chất : S, H2S, H2SO4, SO2 lần lượt là :
A. 0, +2, +6, +4. B. 0, -2, +4, -4. C. 0, –2, –6, +4. D. 0, –2, +6, +4.
Câu 5: Cho các ion sau: Mg2+, SO42-, Al3+, S2-, Na+, Fe3+, NH4+, CO32-, Cl–. Số ion đơn nguyên tử là:
A. 5. B. 6. C. 4 D. 3.
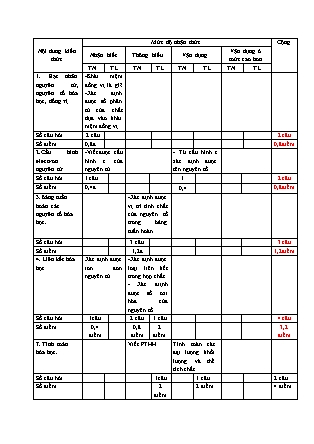
Nội dung kiến thức Mức độ nhận thức Cộng Nhận biết Thông hiểu Vận dụng Vận dụng ở mức cao hơn TN TL TN TL TN TL TN TL 1. Hạt nhân nguyên tử, nguyên tố hóa học, đồng vị -Khái niệm đồng vị là gì? -Xác định được số phân tử của chất dựa vào khái niệm đồng vị. Số câu hỏi 2 câu 2 câu Số điểm 0,8đ 0,8điểm 2.Cấu hình electron nguyên tử -Viết được cấu hình e của nguyên tử - Từ cấu hình e xác định được tên nguyên tố. Số câu hỏi 1 câu 1 2 câu Số điểm 0,4đ 0,4 0,8điểm 3.Bảng tuần hoàn các nguyên tố hóa học. -Xác định được vị trí tính chất của nguyên tố trong bảng tuần hoàn. Số câu hỏi 3 câu 3 câu Số điểm 1,2đ 1,2điểm 4. Liên kết hóa học Xác định được ion đơn nguyên tử. -Xác định được loại liên kết trong hợp chất. - Xác điịnh được số oxi hóa của nguyên tố. Số câu hỏi 1câu 2 câu 1 câu 4 câu Số điểm 0,4 điểm 0,8 điểm 2 điểm 3,2 điểm 7. Tính toán hóa học. Viết PTHH. Tính toán các đại lượng khối lượng và thể tích chất. Số câu hỏi 1câu 1 câu 2 câu Số điểm 2 điểm 2 điểm 4 điểm Tổng câu hỏi 4 câu 5 câu 2 1 câu 1 câu 13câu Tổng điểm 1,6 điểm 2 điểm 4 0,4 điêm 2 điểm 10 điểm SỞ GD & ĐT HẢI PHÒNG GDNN-GDTX QUẬN KIẾN AN ĐỀ KIỂM TRA HỌC KỲ I NĂM HỌC 2020-2021 Môn: Hoá. Lớp: 10 Ngày kiểm tra: /01/2021 Thời gian làm bài: 45 phút Trắc nghiệm Câu 1: Cho các nguyên tử có kí hiệu sau: . Nhận định nào sau đây đúng khi nói về 3 nguyên tử trên: A. X, Y thuộc cùng một nguyên tố hoá học B. X, T là 2 đồng vị của cùng một nguyên tố hoá học C. X và T có cùng số khối D. X và Y có cùng số nơtron Câu 2: Cho các chất sau: NH3, HCl, SO3, N2. Chúng có kiểu liên kết hoá học nào sau đây: A. Liên kết cộng hoá trị phân cực B. Liên kết cộng hoá trị không phân cực C. Liên kết cộng hoá trị D. Liên kết ion Câu 3: Cấu hình electron của X là: 1s22s22p63s23p1 thì X là nguyên tố: A. Al B. Ca C. Ar D. Cl Câu 4: Số oxi hoá của nguyên tố lưu huỳnh trong các chất : S, H2S, H2SO4, SO2 lần lượt là : A. 0, +2, +6, +4. B. 0, -2, +4, -4. C. 0, –2, –6, +4. D. 0, –2, +6, +4. Câu 5: Cho các ion sau: Mg2+, SO42-, Al3+, S2-, Na+, Fe3+, NH4+, CO32-, Cl–. Số ion đơn nguyên tử là: A. 5. B. 6. C. 4 D. 3. Câu 6: Nguyên tử canxi có kí hiệu là .Cấu hình electron của nguyên tử Ca là: A.1s22s22p63s23p63d2. B. 1s22s22p63s23p64s2. C. 1s22s22p103s23p4. D. 1s22s22p63s23p8. Câu 7: Cấu hình electron của nguyên tử 39X là 1s22s22p63s23p64s1. Nguyên tử 39X có đặc điểm : A. Nguyên tố thuộc chu kì 4, nhóm IA; B. Số nơtron trong hạt nhân nguyên tử X là 22; C. X là nguyên tố phi kim mạnh; D. X có tổng số hạt proton và nơtron là 42. Câu 8: Nguyên tố cacbon và oxi có các đồng vị sau: C, C ; O; O; O. Số phân tử CO2 tối đa tạo từ các đồng vị trên là: A. 9. B. 8. C. 18. D. 12. Câu 9: Cho biết cấu hình electron của các nguyên tố: X : 1s22s22p63s23p4 ; Y : 1s22s22p63s23p64s2 ; Z : 1s22s22p63s23p6. Nguyên tố nào là kim loại ? A. X và Y B. Z C. Y D. X Câu 10: Nguyên tố A có Z = 18,vị trí của A trong bảng tuần hoàn là: A. chu kì 3, phân nhóm VIB B. chu kì 3, phân nhóm VIIIA C. chu kì 3, phân nhóm VIA D. chu kì 3, phân nhóm VIIIB II. Tự luận Câu 1.Hoàn thành các phương trình hóa học sau: Al + HCl → ? + ? NaOH + H2SO4 → ? + ? Câu 2. Xác định số oxi hóa của Cr trong các hợp chất sau: Cr2O3, K2CrO4, K2CrO7, CrO4-2 Câu 3: Hòa tan hoàn toàn 5,6 gam Fe bằng một lượng vừa đủ dung dịch H2SO4 loãng, thu được V lít hiđro (ở đktc) và dung dịch chứa m gam muối. Giá trị của v, m là bao nhiêu? (Cho H = 1; Mg = 24; S = 32; Fe = 56 ,O=16) ĐÁP ÁN I. Trắc nghiệm 1 2 3 4 5 6 7 8 9 10 B D A D B B A D C B II.Tự luận Câu Đáp án Thang điểm 1 2Al + 6HCl → 2 AlCl3 + 3H2 2NaOH + H2SO4 → Na2SO4 + H2O 1đ 1đ 2 Cr2O3: 2.x+(-2).3=0 → x=+3 K2CrO4: 2.(+1) + x+(-2).4=0 → x=+6 K2Cr2O7: 2.(+1) + 2.x+(-2).7=0 → x= +6 CrO4-2 : x+(-2).4=-2 → x=+6 0,5đ 0,5đ 0,5đ 0,5đ 3 nFe= =0,1 (mol). Fe + H2SO4 → FeSO4 + H2. nFeSO4 = nFe= 0,1 mol → mFeSO4=152x0,1=15,2 gam nH2=nFe=0,1 mol → VH2=0,1x22,4=2,24 lít 0,5đ 0,5đ 0,5đ 0,5đ
Tài liệu đính kèm:
 de_kiem_tra_hoc_ky_i_mon_hoa_lop_10.doc
de_kiem_tra_hoc_ky_i_mon_hoa_lop_10.doc



