Bài tập Hóa học Lớp 11 - Nitơ. Photpho
Các trường hợp đặc biệt cần lưu ý
+ HNO3 loãng: thường tạo sản phẩm khử là NO, HNO3 đặc: tạo NO2.
+ Al, Cr, Fe không phản ứng với HNO3 đặc nguội.
+ NO: khí không màu, hóa nâu ngoài không khí (HNO3 loãng)
+ NO2: khí nâu đỏ (HNO3 đặc)
+ N2O: khí không màu, nặng hơn không khí, N2: khí không màu, nhẹ hơn không khí.
+ Mg, Al, Zn: thường tạo sản phẩm khử là NH4NO3 – muối.
Bạn đang xem tài liệu "Bài tập Hóa học Lớp 11 - Nitơ. Photpho", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
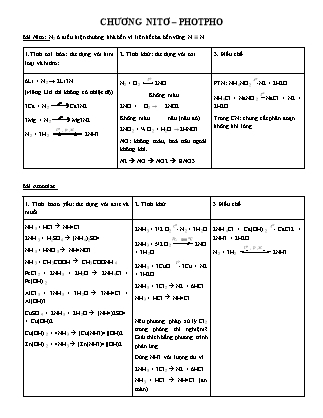
CHƯƠNG NITƠ – PHOTPHO Bài Nitơ: N2 ở điều kiện thường khá bền vì liên kết ba bền vững N≡N 1.Tính oxi hóa: tác dụng với kim loại và hidro: 2. Tính khử: tác dụng với oxi 3. Điều chế 6Li + N2 → 2Li3N (riêng Liti thì không có nhiệt độ) 3Ca + N2 Ca3N2 3Mg + N2 Mg3N2 N2 + 3H2 to , p , xt 2NH3 N2 + O2 to 2NO Không màu 2NO + O2 → 2NO2 Không màu nâu (nâu đỏ) 2NO2 + ½ O2 + H2O → 2HNO3 NO: không màu, hoá nâu ngoài không khí. N2 à NO à NO2 à HNO3 PTN: NH4NO2 to N2 + 2H2O NH4Cl + NaNO2 to NaCl + N2 + 2H2O Trong CN: chưng cất phân đoạn không khí lỏng. Bài Amoniac 1. Tính bazơ yếu: tác dụng với axit và muối 2. Tính khử 3 Điều chế NH3 + HCl à NH4Cl 2NH3 + H2SO4 à (NH4)2SO4 NH3 + HNO3 à NH4NO3 NH3 + CH3COOH à CH3COONH4 FeCl2 + 2NH3 + 2H2O à 2NH4Cl + Fe(OH)2 AlCl3 + 3NH3 + 3H2O à 3NH4Cl + Al(OH)3 CuSO4 + 2NH3 + 2H2O à (NH4)2SO4 + Cu(OH)2 Cu(OH)2 + 4NH3 à [Cu(NH3)4](OH)2 Zn(OH)2 + 4NH3 à [Zn(NH3)4](OH)2 2NH3 + 3/2 O2 to N2 + 3H2O 2NH3 + 5/2 O2 Pt, 800oC 2NO + 3H2O 2NH3 + 3CuO to 3Cu + N2 + 3H2O 2NH3 + 3Cl2 à N2 + 6HCl NH3 + HCl à NH4Cl Nêu phương pháp xử lý Cl2 trong phòng thí nghiệm? Giải thích bằng phương trình phản ứng. Dùng NH3 với lượng dư vì 2NH3 + 3Cl2 à N2 + 6HCl NH3 + HCl à NH4Cl (an toàn) 2NH4Cl + Ca(OH)2 to CaCl2 + 2NH3 + 2H2O N2 + 3H2 to , p , xt 2NH3 Khi cho NH3 đặc tác dụng với dung dịch HCl đặc sẽ có hiện tượng “khói trắng” Bài muối amoni 1. Tác dụng với bazơ (khi viết chuỗi từ muối ra NH3) 2. Phản ứng nhiệt phân NH4Cl + NaOH à NaCl + NH3 + H2O 2NH4Cl + Ba(OH)2 à BaCl2 + 2NH3 + 2H2O (NH4)2SO4 + Ba(OH)2 à BaSO4 + 2NH3 + 2H2O NH4Cl to NH3 + HCl (NH4)2CO3 to NH3 + NH4HCO3 NH4HCO3 to NH3 + CO2 + H2O (NH4)2CO3 to NH3 + CO2 + H2O NH4NO2 to N2 + 2H2O NH4NO3 to N2O + 2H2O NH4NO3 p cao, to N2 + 1/2O2 + 2H2O Bài axit nitric (HNO3) 1. Tác dụng với kim loại (-Au, Pt) NO2 NO R + HNO3 → R(NO3)n + N2O + H2O (-Au, Pt) N2 NH4NO3 Các trường hợp đặc biệt cần lưu ý + HNO3 loãng: thường tạo sản phẩm khử là NO, HNO3 đặc: tạo NO2. + Al, Cr, Fe không phản ứng với HNO3 đặc nguội. + NO: khí không màu, hóa nâu ngoài không khí (HNO3 loãng) + NO2: khí nâu đỏ (HNO3 đặc) + N2O: khí không màu, nặng hơn không khí, N2: khí không màu, nhẹ hơn không khí. + Mg, Al, Zn: thường tạo sản phẩm khử là NH4NO3 – muối. Ag + HNO3 loãng → ...................+ NO + ............................... Cu + HNO3 loãng → ...................+ NO + .................................... Mg + HNO3 đặc → ...................+ NO2 + .................................... Mg + HNO3 loãng → ...................+ NH4NO3 + .................................... 2. Tác dụng với phi kim S + HNO3 đặc →..............................+ NO2 + ................................... C + HNO3 đặc →.............................+ NO2 + ................................... P + HNO3 đặc →.............................+ NO2 + ................................... 3. Tác dụng với hợp chất (có tính khử) FeO + HNO3 → .............................+ NO + ................................... Fe3O4 + HNO3 → .............................+ NO + ................................... Fe2O3 + HNO3 → CuO + HNO3 → ZnO + HNO3 → 4. Điều chế HNO3 a) Trong phòng thí nghiệm NaNO3 + H2SO4 HNO3 + NaHSO4 b) Trong CN 2NH3 + 5/2 O2 2NO + 3H2O NO + ½ O2 → NO2 2NO2 + ½ O2 + H2O → HNO3 Bài muối nitrat Nhiệt phân muối nitrat Dãy hoạt động hóa học của kim loại: + Na, K: RNO3 to RNO2 + O2 + Mg → Cu : RNO3 to R2On + NO2 + O2 + Hg, Ag, Pt, Au RNO3 to R + NO2 + O2 Vd: NaNO3 KNO3 Vd: Zn(NO3)2 Fe(NO3)2 Vd: Hg(NO3)2 AgNO3 Bài Photpho 1. Tính oxi hóa: tác dụng với kim loại và hidro 2. Tính khử: tác dụng với oxi 3. Điều chế 3Na + P to Na3P 3Mg + 2P to Mg3P2 Al + P to AlP 2P + 3/2O2 thiếuto P2O3 2P + 5/2O2 dư to P2O5 Ca3(PO4)2 + 5C + 3SiO2 5CO + 3P + 3CaSiO3 Bài axit photphoric 1. Tác dụng với kim loại 2. Tác dụng với bazơ ( theo tỉ lệ 1,2,3) 3. Điều chế 6Na + 2H3PO4 à 2Na3PO4 + 3H2 3Mg + 2H3PO4 à Mg3(PO4)2 + 3H2 2Al + 2H3PO4 à 2AlPO4 + 3H2 H3PO4 + NaOH à NaH2PO4 + H2O H3PO4 + 2NaOH à Na2HPO4 + 2H2O H3PO4 + 3NaOH à Na3PO4 + 3H2O a) Trong phòng thí nghiệm P + 5HNO3 H3PO4 + 5NO2 + H2O b) Trong CN Ca3(PO4)2 + 3 H2SO4 2H3PO4 + 3CaSO4 Hay: 2P + 5/2 O2 P2O5 P2O5 + 3H2O → 2H3PO4
Tài liệu đính kèm:
 bai_tap_hoa_hoc_lop_11_nito_photpho.docx
bai_tap_hoa_hoc_lop_11_nito_photpho.docx



