Bài tập Hóa học Lớp 11
Bài 1. Cho các nguyên tố sau:
6C Ca , Ar , Zn , Cu .
Xác định vị trí của chúng trong BTH.
Bài 2. Xác định số oxi hóa của các nguyên tố trong hợp chất , đơn chất và ion sau:
a) H2S, S, SO2, H2SO3, H2SO4.
b) HCl, HClO, HClO3, NO3-,Fe2+ , Fe3+,
c) CO2, H2O, SO3, NH3, NO2, Na+, Cu2+ , Al3+
Bài 3. Viết quá trình hình thành ion của các nguyên tố sau, từ đó viết cấu hình electron của ion được tạo thành. Al (Z= 13),Cl (Z = 17), Ca (Z = 20), Br (Z = 35), P (Z = 15), Fe (Z = 26), S (Z = 16), F (Z = 9), Zn (Z= 30), O (Z = 8).
Bài 4. Cân bằng các phản ứng sau theo phương pháp oxi hoá khử.
1. Mg + HNO3 Mg(NO3)2 + NO + H2O.
2. Al + HNO3 Al(NO3)3 + NO2 + H2O.
3. Al + H2SO4 đ Al2(SO4)3 + SO2 + H2O.
4. Fe + HNO3 Fe(NO3)3 + N2O +H2O.
5. FeO + H2SO4đ Fe2(SO4)3 + S + H2O.
6. Al + HNO3 Al(NO3)3 + NH4NO3 + H2O.
7. HCl + KMnO4 KCl + MnCl2 + Cl2 + H2O.
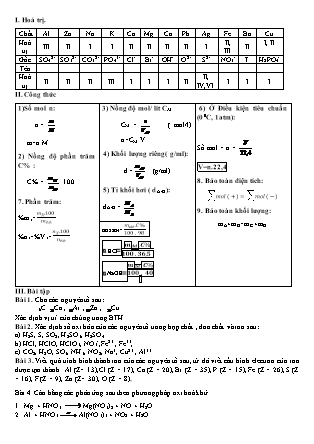
I. Hoá trị. Chất Al Zn Na K Ca Mg Ca Pb Ag Fe Ba Cu Hoá trị III II I I II II II II I II, III II I, II Gốc SO42- SO32- CO32- PO43- Cl- Br- OH- O2- S2- NO3- I- H2PO4- Tên Hoá trị II II II III I I I II II, IV,VI I I I II. Công thức 1)Số mol n: n = m=n.M 2) Nồng độ phần trăm C% : C% = . 100 7. Phần trăm: %mx=mX.100mhh %nx=%Vx=nX.100nhh 3) Nồng độ mol/ lit CM CM = ( mol/l) n=CM.V 4) Khối lượng riêng( g/ml): d = (g/ml) 5) Tỉ khối hơi ( dA/B ): dA/B = nH2SO4=mdd.C%100 . 98 nHCl=mdd.C%100 . 36,5 nNaOH=mdd.C%100 . 40 6) Ở Điều kiện tiêu chuẩn (00C, 1atm): Số mol = n = V=n.22,4 8. Bảo toàn điện tích: mol (+)=mol (-) 9. Bảo toàn khối lượng: mA+mB=mC+mD III. Bài tập Bài 1. Cho các nguyên tố sau: 6C Ca , Ar ,Zn , Cu . Xác định vị trí của chúng trong BTH. Bài 2. Xác định số oxi hóa của các nguyên tố trong hợp chất , đơn chất và ion sau: a) H2S, S, SO2, H2SO3, H2SO4. b) HCl, HClO, HClO3, NO3-,Fe2+ , Fe3+, c) CO2, H2O, SO3, NH3, NO2, Na+, Cu2+ , Al3+ Bài 3. Viết quá trình hình thành ion của các nguyên tố sau, từ đó viết cấu hình electron của ion được tạo thành. Al (Z= 13),Cl (Z = 17), Ca (Z = 20), Br (Z = 35), P (Z = 15), Fe (Z = 26), S (Z = 16), F (Z = 9), Zn (Z= 30), O (Z = 8). Bài 4. Cân bằng các phản ứng sau theo phương pháp oxi hoá khử. Mg + HNO3 Mg(NO3)2 + NO + H2O. Al + HNO3 Al(NO3)3 + NO2 + H2O. Al + H2SO4 đ Al2(SO4)3 + SO2 + H2O. Fe + HNO3 Fe(NO3)3 + N2O +H2O. FeO + H2SO4đ Fe2(SO4)3 + S + H2O. Al + HNO3 Al(NO3)3 + NH4NO3 + H2O. HCl + KMnO4 KCl + MnCl2 + Cl2 + H2O. Bài 5. Hoàn thành các phản ứng sau: 1) dd Na2CO3 và dd HCl 2) Fe(OH)3 và dd HCl 3) CuO và dd HCl 4) dd AgNO3 và dd HCl 5) dd CaCl2 và dd AgNO3 6) FeO và dd HCl Bài 6. Hoàn thành các chuỗi phản ứng sau: KMnO4 Cl2 HCl AlCl3 Al(NO3)3 FeCl3 FeCl2 CO2 b. KMnO4O2 Fe2O3 FeCl3 AgCl Cl2 NaClO Bài 7. Nhận biết các dung dịch mất nhãn sau bằng phương pháp hoá học: a. KOH , KCl, K2SO4 , KNO3 c.NaCl, HCl, KOH, NaNO3, NaBr b. HCl, NaOH, Ba(OH)2 , Na2SO4 d. NaCl, NaBr, NaI, Na2SO4 Bài 8. Cho 0,92 g một kim loại thuộc nhóm IA tác dụng hết với H2O, sau phản ứng thu được 0,448 lít khí H2 (đkc). Hãy xác định tên kim loại này. Hoà tan 6,85g kim loại R thuộc nhóm IIA cần vừa đủ 91,25 gam dung dịch HCl thu được 1,12 lít khí (đktc). Xác định tên kim loại R và tính nồng độ C% của dung dịch HCl. Cho 0,96 g một kim loại có hóa trị II tác dụng hết với 400 ml dung dịch HCl 0,2M. Xác định tên của R, tính thể tích khí H2 thu được (ở đkc) và khối lượng muối sau phản ứng. Cho 0.81 gam kim loại R có hóa trị III tác dụng hết với 50 gam dung dịch HCl 6,57%. Hãy tìm kim loại và tính thể tích khí H2(đkc) thu được sau phản ứng. 5. Cho 1,44 gam kim loại R (hóa trị II) tác dụng với dung dịch H2SO4 đặc nóng, sau phản ứng thu được 1,344 lít khí SO2 (đkc). Hãy xác định tên của R. 6. Cho 1,62 gam kim loại R (hóa trị III) tác dụng với dung dịch H2SO4 đặc nóng, sau phản ứng thu được 2,016 lít khí SO2 (dkc). Hãy xác định tên kim loại này Bài 9. Hãy tính khối lượng các chất thu được sau phản ứng: 1. Dẫn 6,72 lít khí SO2 (đkc) đi qua bình đựng 150 ml dung dịch NaOH 1 M. 2. Cho 1,344 lít SO2 (đkc) vào 300 ml dung dịch NaOH 0,2M. 3. Dẫn 12,8 g khí SO2 đi qua bình đựng 60 gam dung dịch KOH 28%. 4. Dẫn 6,72 lít khí SO2 (đkc) đi qua bình đựng 60 ml dung dịch NaOH 1,25 M. 5. Dẫn 4,48 lít khí SO2 (đkc) đi qua bình đựng 80 gam dung dịch NaOH 8%. Bài 10. 1. Cho 2,4 gam hỗn hợp hai kim loại Ca và Mg tác dụng hết với 200 ml dd HCl, sau phản ứng thu được 1,792 lít khí (đkc). Hãy tính thành phần % theo khối lượng từng kim loại và nồng độ CM của dd HCl đã phản ứng. 2. Cho 4,96 gam hỗn hợp hai kim loại Al, Fe tác dụng hết với 80 gam dung dịch HCl, sau phản ứng thu được 3,808 lít khí (đkc). Hãy tính thành phần % theo khối lượng từng kim loại, nồng độ C% của dd HCl đã phản ứng và tổng khối lượng muối thu được. 3. Cho 32,8 gam hỗn hợp hai kim loại Mg và Cu tác dụng với dung dịch HCl, sau phản ứng thu được 6,72 lít khí (đkc). Tính % theo khối lượng mỗi kim loại. 4. Cho 9,28 gam hỗn hợp hai kim loại Fe và Cu tác dụng với dung dịch HCl, sau phản ứng thu được 2,688 lít khí (đkc). Tính % theo số mol mỗi kim loại trong hỗn hợp đầu. 5. Cho 11,88 gam hỗn hợp hai muối Na2CO3 và K2CO3 tác dụng với 150 ml dung dịch HCl, sau phản ứng thu được 12,98 gam hỗn hợp muối clorua. Tính % theo số mol muối trong hỗn hợp đầu, nồng độ CM của dung dịch HCl phản ứng và thể tích khí thoát ra ở đkc. 6. Cho 1,5 gam hỗn hợp hai kim loại Al và Mg tác dụng hết với 200 gam dung dịch H2SO4 loãng, sau phản ứng thu được 1,568 lít khí H2 (đkc). Tính % theo khối lượng từng kim loại. Toàn bộ lượng muối sunfat thu được cho tác dụng với dung dịch BaCl2 thu được m gam kết tủa. Tính giá trị của m. 7. Hòa tan 35,2 gam hỗn hợp Fe và CuO vào 200ml dung dịch H2SO4 loãng vừa đủ, sau phản ứng thu được 4,48 lít khí (đkc) và dung dịch A. a. Tính % theo khối lượng của CuO trong hỗn hợp. b. Cho toàn bộ dung dịch A tác dụng hết với lượng dư dung dịch NaOH, hãy tính khối lượng kết tủa thu được sau phản ứng. 8. Hòa tan hoàn toàn 54,4 gam hỗn hợp hai kim loại Fe và Cu vào dung dịch H2SO4 đặc nóng, sau phản ứng thu được 24,64 lít khí SO2 duy nhất thoát ra ở đkc. Hãy tính % theo số mol từng kim loại trong hỗn hợp đầu. IV. TRẮC NGHIỆM Câu 1. Cấu hình electron lớp ngoài cùng của các nguyên tử Halogen là: A. ns2 np4. B. ns2 np5 C. ns2 np6 D. (n – 1)d10 ns2 np5. Câu 2. Trong nước clo có chứa các chất: A. HCl, HClO B. HCl, HClO, Cl2 C. HCl, Cl2 D. Cl2 Câu 3. Hòa tan khí Cl2 vào dung dịch NaOH loãng, dư ở nhiệt độ phòng thu được dung dịch chứa các chất A. NaCl, NaClO3, Cl2 B. NaCl, NaClO, NaOH C. NaCl, NaClO3, NaOH D. NaCl, NaClO3 Câu 4. Có ba lọ đựng ba khí riêng biệt là clo, hidroclorua và oxi. Có thể dùng một chất nào trong số các chất sau để đồng thời nhận ra được cả ba khí trên? A. Giấy quỳ tím tẩm ướt B. Dd Ca(OH)2 C. Dd BaCl2 D. Dd H2SO4 Câu 5. Trong muối NaCl có lẫn NaBr và NaI. Để loại hai muối này ra khỏi NaCl người ta có thể A. nung nóng hỗn hợp. B. cho hỗn hợp tác dụng với dung dịch HCl đặc. C. cho hỗn hợp tác dụng với Cl2 sau đó đun nóng. D. cả A, B và C. Câu 6.Để điều chế clo, người ta có thể làm như sau: A. Điện phân muối NaCl nóng chảy hoặc dung dịch NaCl bão hòa có màng ngăn. B. Cho KMnO4 hoặc MnO2 tác dụng với dung dịch HCl đặc. C. Cho KClO3 tác dụng với dung dịch HCl đặc. D. A hoặc B hoặc C. Câu 7. Phát biểu nào sau đây không chính xác: A. Halogen là những phi kim điển hình, chúng là những chất oxi hóa. B. Trong hợp chất các halogen đều có thể có số oxi hóa: -1, +1, +3, +5, +7. C. Khả năng oxi hóa của halogen giảm dần từ flo đến iot D. Các halogen khá giống nhau về tính chất hóa học. Câu 8. Sắp xếp theo chiều tăng tính oxi hóa của các nguyên tử là: A. I, Cl, Br, F B. Cl,I,F,Br. C. I,Br,Cl,F D. I,Cl,F,Br Câu 9.Công thức hoá học của clorua vôi là: A. CaCl2 B. CaOCl2 C. Ca(ClO)2 D. hỗn hợp A, B và C Câu 10. Cho các cặp chất sau, những cặp chất nào không phản ứng được với nhaủ A. H2O và F2 B. dd KBr và Cl2 C. dd KCl và I2 D. dd HF và SiO2 Câu 11. Nước Giaven là hỗn hợp các chất nào sau đây? A.HCl,HClO,H2O B.NaCl,NaClO,H2O C.NaCl,NaClO3,H2O D.NaCl,NaClO4,H2O Câu 12. Tính axit của các axit HX được sắp xếp theo thứ tự giảm dần ở dãy nào dưới đây là đúng ? A. HF, HCl, HBr, HI B. HI, HBr, HCl, HF C. HCl, HBr, HI, HF D. HBr, HCl, HI, HF Câu 13. Các dãy chất nào sau đây mà các nguyên tử nguyên tố halgen có số oxi hoá tăng dần : A. HBrO,F2O,HClO2,Cl2O7, HClO3. B. F2O, Cl2O7, HClO2, HClO3, HBrO. C. F2O, HBrO, HClO2, HClO3, Cl2O7. D. HClO3, HBrO, F2O, Cl2O7, HClO2. Câu 14. Chất nào sau đây không thể tác dụng với dung dịch HCl? A. Al2O3. B. MgCO3. C. Cu. D. NaOH. Câu 15. Khí SO2 không tác dụng được với chất nào sau đây? A. O2. B. dung dịch HCl. C. dung dịch NaOH. D. dung dịch brom. Câu 16. Cho phản ứng sau: Fe + H2SO4 đặc Fe2(SO4)3 + SO2 + H2O. Hệ số cân bằng của phản ứng là A. 1, 2, 1, 1, 2. B. 1, 3, 1, 1, 3. C. 2, 6, 1, 3, 6. D. 3, 6, 1, 3, 6. Câu 17. Cho các chất sau: Al, H2, H2O, Fe. Có bao nhiêu chất cho được phản ứng với khí clo? A. 2. B. 3. C. 4. D. 1. Câu 18. Để nhận biết dung dịch axit clohidric có thể dùng thuốc thử là A. quỳ tím. B. dung dịch AgNO3. C. quỳ tím hoặc dung dịch AgNO3. D. dung dịch NaOH hoặc dung dịch AgNO3. Câu 19. Kim loại nào sau đây cho tác dụng với dung dịch HCl và khí clo tạo cùng một muối clorua? A. Fe. B. Cu. C. Ag. D. Mg. Câu 20. Natri sunfat có công thức hóa học là A. NaHSO4. B. Na2SO3. C. Na2S. D. Na2SO4. Câu 21. Kim loại sắt tác dụng với dung dịch HCl thu được sản phẩm là A. FeCl2 + H2O. B. FeCl3 + H2. C. FeCl2+ H2. D. FeCl2 + H2O. Câu 22. Tính chất hóa học đặc trưng của khí H2S là A. tính axit mạnh. B. tính oxi hóa mạnh. C. tính khử mạnh. D. tính oxi hóa yếu. Câu 23. Dung dịch axit H2SO4 đặc nguội không tác dụng được với kim loại nào sau đây? A. Al, Mg. B. Cu, Al. C. Al, Zn. D. Al, Fe Câu 24. Để thu được muối dung dịch CuSO4 người ta không thể dùng phản ứng hóa học nào sau đây? A. CuO + dung dịch H2SO4 B. Cu + dung dịch H2SO4 đặc C. Cu(OH)2 + dung dịch H2SO4 D. Cu + dung dịch H2SO4 Câu 25. Để nhận biết 2 dung dịch HCl và H2SO4 có thể dùng thuốc thử là A. quỳ tím. B. dung dịch AgNO3. C. dung dịch BaCl2. D. dung dịch NaOH.
Tài liệu đính kèm:
 bai_tap_hoa_hoc_lop_11.docx
bai_tap_hoa_hoc_lop_11.docx



